Immunmediatoren, Zytokine und Chemokine sind in der modernen Zahnmedizin als Botenstoffe indentifiziert worden, die die Fernwirkungen von „Kiefer-Störfeldern“ bestens erklären.

Biochemische Vernetzung
Kiefer-Organe
Immunmediatoren, Zytokine und Chemokine sind in der modernen Zahnmedizin als Botenstoffe indentifiziert worden, die die Fernwirkungen von „Kiefer-Störfeldern“ bestens erklären.
Am Beispiel der rheumatischen Arthritis zeigt sich die Bedeutung für den Patienten und die klinische Relevanz:
Immunbotenstoffe und NICO – oder: Die fettige Degeneration als Schlüssel zur Systemwirkung der NICO
In unserer Praxisklinik werden immer wieder – nach operativer Säuberung schmerzloser und röntgenologisch unauffälliger zahnloser Kieferbereiche -verblüffende Verbesserungen systemischer Beschwerden rheumatiformer, neuralgiformer und anderer chronisch entzündlicher Systemerkrankungen beobachtet. Diese zeichnen sich strukturell durch eine fettig-degenerative Osteonekrose des Spongiosaanteils aus. Bislang gibt es in der medizinischen und zahnmedizinischen Literatur wenig wissenschaftlich gesicherte Erklärungen für die oben genannten systemischen Therapieerfolge. Die Fragestellung unserer Studie war deshalb:
- Lassen sich grundsätzlich Immunbotenstoffe, Zytokine, Wachstumsfaktoren in Proben des degenerierten Kiefergewebes nachweisen?
- Können die nachweisbaren Immunbotenstoffen Hinweise auf Entzündungsprozesse in dem degenerierten Kiefergewebe geben?
- Welche Immunbotenstoffe treten in dem NICO-Gewebe auf und lassen sich darüber möglicherweise Zusammenhänge zu Systemerkrankungen herstellen?
Seit einiger Zeit ist bekannt, dass nicht nur Immunzellen, sondern in geringerem Umfang auch Fettzellen Botenstoffe der Entzündung bilden. Diese Fettzellen finde sich sehr ausgeprägt in allen unseren NICO-Proben:
Wir haben bei unserem Kollektiv (n=31) insgesamt 7 Zytokine in NICO Gewebe gemessen. Verteilung und Konzentration der Immunmediatoren zeigt Abbildung 1, wobei sich ein deutliches Übergewicht von IL1-ra (Interleukin 1 Rezeptor Antagonist), RANTES und FGF-2 zeigt. Das Prinzip von Up-Regulation (inflammatorisch/RANTES) und gegenläufige Down-Regulation (anti-inflammatorisch/Il1 RA) erklärt, warum NICO ohne typische Entzündungszeichen asymptomatisch abläuft. Deutlich wird sichtbar, dass die proentzündlichen Akutzytokine IL 1 und TNF-Alpha nicht erhöht waren, was in einem chronisch-blanden Pozess wie der NICO-Osteolyse auch nicht zu erwarten ist. Parallel wurden 3 gesunde Knochenproben unersucht: In der Literatur fanden sich keine Vergleichswerte für diese Mediatoren in gesundem Kieferknochen. Abbildung 2 vergleicht die Mittelwerte der 3 gesunden Knochenproben mit den Medianen von 7 Zytokinen aus 31 NICO Proben.
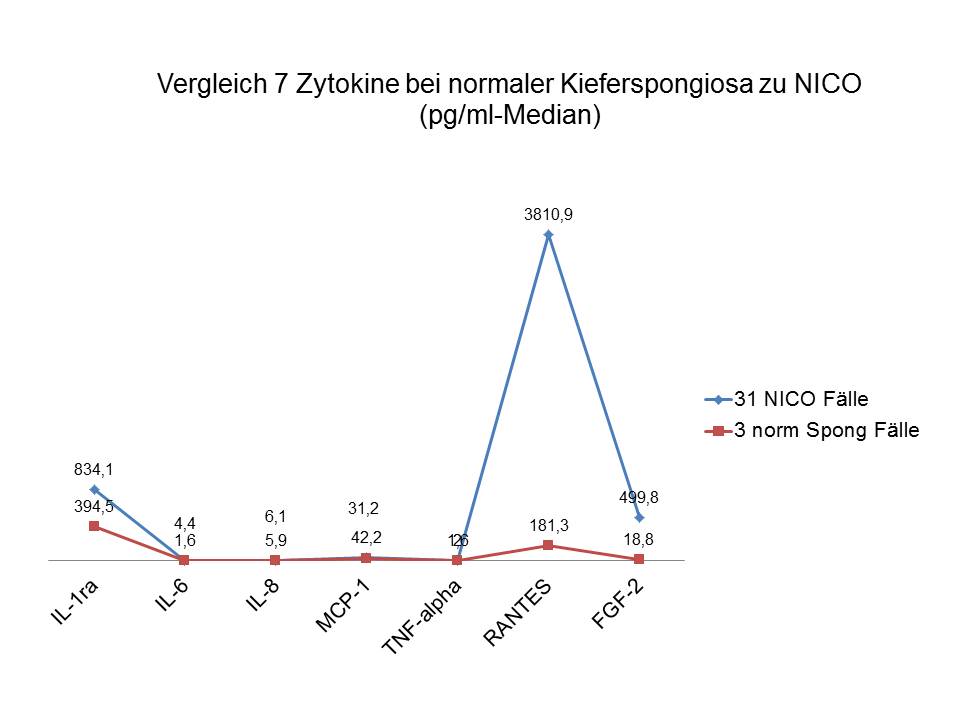
Abb 1: Vergleich 7 Zytokine aus 3x gesunder Spongiosa zu 31 NICO Fällen
Systemrelevanz der erhöhten NICO-Zytokine – oder: Gibt es einen Zusammenhang von erhöhten RANTES-Zytokinspiegel der NICO und rheumatischer Arthritis?
Die Faszination unserer Arbeit liegt darin, dass sie einerseits ein ganzheitliches Erklärungsmodell für die seit Jahrzehnten berichteten Sanierungserfolge der sogenannten „Kieferostitis und Kiefer-Störfelder“ abgibt und andererseits den Schlüssel zu einer systemorientierten Behandlung verschiedenster chronischer Erkrankungen liefern könnte. Diese Arbeit interpretiert nur stichwortartig die möglichen pathogenetischen Wirkungen der im NICO-Areal erhöhten Immunbotenstoffe – in Konzentration auf das rheumatische Arthritis (RA). Grundsätzlich gehe ich von folgender Hypothese aus:
- Vom chronisch-schwellenden Prozess der NICO gehen ständige Stimuli aus, die für die jeweiligen erhöhten Zytokine charakteristisch sind.
- Perpetuierende Stimuli dieser immunologischen Signalstoffe führen über Jahre und Jahrzehnte zu einer Hypersensibilisierung entsprechender Organe und Organsysteme an deren Ende – weitere aktualisierende Kofaktoren vorausgesetzt – das klinische Symptom in Form der spezifischen Erkrankung steht.
Das Problem der „blanden“, also nicht spürbaren NICO-Osteolysen des Kieferknochens ist ähnlich kleinen Wellen, die ständig sanft an die Küste schlagen: Es ist ein ausgesprochen niedriges Aktivitätsniveau, das über Jahre einwirkend den Strand wegspült und andere schlimme Folgen hervorruft.
- NICO ist ein vollständig stummes Geschehen, bleibt von Arzt und Patient gleichermaßen unerkannt und löst deshalb unendlich lange Leidenswege aus.
- NICO ist kein akut-entzündliches Geschehen, das in die bekannten Vorstellungen einer „Entzündung“ passt.
Dieses Konzept ist besonders faszinierend, da es einen neuen und möglicherweise einfacheren Weg zur Verhinderung und Vorbeugung von Krankheiten nahe legt: Die Ausschaltung chronischer Entzündungsherde, die auf den Gesamtorganismus über sogenannte Entzündungsmediatoren wirken. Dabei sind die unbekannten und unerkannten NICO-Areale auf Grund ihrer morphologischen und histologischen Charakteristika ein Angelpunkt für diesen medizinischen Ansatz.
RANTES und destruktive Signalgebung aus NICO
RANTES (CCL-5) ist ein chemotaktisches Zytokin mit proinflammatorischer Wirkung.
Bedeutung von RANTES für die Entstehung von Krankheiten: RANTES greift auf mehreren Stufen in Immunreaktionen ein und ist damit an Infektionen oder pathologischen Zuständen maßgeblich beteiligt. Eine unkontrollierte oder übermäßige RANTES-Expression wird als Ursache für die Entstehung unterschiedlicher Krankheitsbilder betrachtet (8). Erhöhte RANTES-Konzentrationen im Serum werden bei einer Vielzahl von entzündlichen Erkrankungen beschrieben, z.B. von Lui 2008 (9) bei Autoimmunerkrankungen, von Kraaijeveld 2007 (10) bei kardiovaskulären Erkrankungen und von Zeremski 2007 (11) bei chronischen Infektionen. Im Serum werden RANTES-Spiegel bis zu ca. 20 ng/ml als unauffällig angesehen (Nomura 2003) (12).
RANTES und NICO: Obwohl die RANTES-Konzentrationen innerhalb der NICO in allen Proben unserer Untersuchungen auffallend hohe Werte zeigen, sind sie im Vergleich doch niedrig zu den RANTES Werten, die bei akuter Arthritis im Serum auftreten. Diese bei akuten Entzündungsgeschehen auftretenden hohen Serum-Werte von RANTES dürfen nicht darüber hinwegtäuschen, dass z.B. die Akutphasen einer Arthritis das Spät- und Finalstadium einer chronisch-asymptomatischen entzündlichen Anbahnungsphase sind. Die im lokalen NICO-Areal stark erhöhten RANTES-Werte lassen bei Einbeziehung des Chronizitätsfaktors die Annahme zu, dass es sich im Bereich der zytokingesteuerten Signalgebung im Körper beim Störfeldgeschehen um ein Provokations-Syndrom handelt: Die über Jahre klinisch unauffällig bestehende RANTES-Spiegel Erhöhung im Bereich der NICO führt zu einer disloziert gesteigerten Ausbildung von RANTES-Spiegeln. Wo diese lokalen entzündlichen Veränderungen oder Prozesse entstehen – im Kniegelenk oder im Bereich eines anderen Organs – ist von genetischen und anderen individuellen Belastungsfaktoren abhängig. RANTES nimmt offensichtlich eine Schüsselstellung bei chronischen Prozessen ein: Blaber et al zeigen in ihrer Studie einen unabhängigen Mechanismus der Vergrößerung von Entzündungen.Dieser Mechanismus kann– gesteuert durch RANTES – kennzeichnend sein für eine anhaltende Beteiligung von Leukozyten in Gebieten chronischer Entzündungen (13).
FGF-2 und RANTES aus NICO bei rheumatischer Arthritis (RA)
Abbildung 2 vergleicht bei 4 Rheuma Patienten die aus den NICO Arealen gewonnenen RANTES und FGF-2 Werte mit aus der Literatur zitierten Werten für entsprechende Kontrollkollektive. Auch hier wird deutlich, dass insbesondere die NICO RANTES Werte bei jedem Einzelfall weit über den RANTES Werten liegen, die direkt in der Synovialflüsssigkeit bei Rheuma/Arthritis Patienten zu finden waren. Die FGF-2 Werte aus NICO liegen ebenfalls in jedem unserer 4 Rheuma Einzelfälle weitaus höher als die Vergleichswerte aus befundfreiem Kieferknochen.
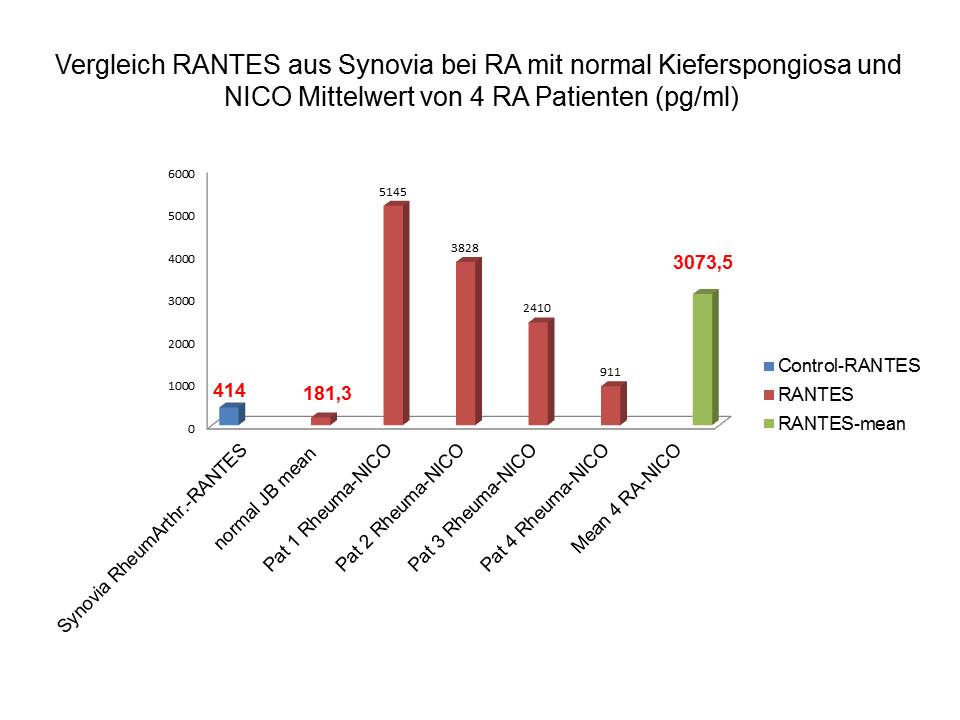
Abb 2: Vergleich von RANTES und FGF-2 NICO Werten bei 4 Rheuma Patienten mit Synovialflüssigkeit und normalem Kieferknochen
a) RANTES und seine Rolle bei RA
Auch die Rheumatoide Arthritis (RA) ist eine Krankheit, für die eine chronische Entzündung mit einer Anhäufung mononucleärer Zellen charakteristisch ist. RANTES wird von menschlichen Fibroblasten in der Synovia (Gelenkinnenhaut) abgesondert und kann daher in einem fortschreitenden entzündlichen Prozess bei rheumatoider Arthritis beteiligt sein. Die Synoviozyten produzieren Synovialflüssigkeit und sezernieren eine Vielzahl von Effectormolekülen, die Entzündungen und Gelenkszerstörungen fördern. Sie selbst sind Teil eines komplexen Netzwerks von autokrinen und parakrinen Faktoren. RANTES wird in vitro nach Stimulation mit TNF-a, IL-1b und IFN-g von rheumatoiden Synovia-Fibroblasten in großen Mengen exprimiert[14]. Da die dadurch angelockten mononucleären Zellen ihrerseits Chemokine (vor allem IL-8, IL-1 und TNF-a) exprimieren, kommt es zu einer Verstärkungsschleife. Dauert der Zustand an, kommt es zur Zerstörung von Knorpel- und Knochengewebe im betreffenden Gelenk [15]. Hirano et al untersuchten die Wirkung von Thrombin auf RANTES mRNA- Expression durch Protease aktivierte Rezeptoren synovialer Fibroblasten bei Patienten mit rheumatoider Arthritis (RA) Die hochregulierende Wirkung des Thrombins auf RANTES mRNA Expression wurde getestet, wobei Thrombin die Expression von RANTES mRNA zeitabhängig in synovialen Fibroblasten induzierte. Das zeigt möglicherweise, dass Thrombin eine wichtige Rolle bei der Migration von Entzündungszellen zur Synovia innehat und dadurch RANTES rheumatoide Arthritis induziert[16]. Eine chronische Entzündung kann gekennzeichnet sein durch eine Akkumulierung aktivierter Leukozyten am Ort der Entzündung.Da das Chemokin RANTES möglicherweise eine aktive Rolle in der Rekrutierung von Leukozyten an den Ort der Entzündung innehat, untersuchten die Forscher die Fähigkeit kultivierter synovialer Fibroblasten von Patienten mit rheumatoider Arthritis, dieses Chemokin zu produzieren. Sie verglichen seine Regulation mit der des verwandten Chemokingens IL-8. In nicht stimulierten synovialen Fibroblasten war die Expression von mRNA für beide Chemokine nicht nachweisbar. Infolge von Stimulierung mit den Monokinen TNF-alpha und IL-1beta stieg sie jedoch zeit- und dosisabhängig an. Diese Studien zeigen, dass durch die Expression der Chemokine RANTES und IL-8 synoviale Fibroblasten möglicherweise am fortschreitenden Entzündungsprozess rheumatischer Arthritis partizipieren [17].
b) FGF-2 und seine Rolle bei RA
Die rheumatoide Arthritis ist gekennzeichnet durch die Proliferation der Synovia, die zur Zerstörung vom Gelenkknochen und Knorpel führt. Auch FGF–2 ist in der Synovia–Flüssigkeit erhöht, wobei die Zellen der Synovia FGF–2 binden und als Reaktion darauf proliferieren [18].
Einzelfall von rheumatischer Arthritis und NICO
Patient 38 Jahre, männlich mit folgender klinischer Symptomatik: Kniegelenksschmerzen rechts seit 12 Monaten. Bisherige medizinische Diagnose: Rheumatiforme Arthritis. Bisherige ärztliche Maßnahmen: Verschreibung von Prednisolon und Metotrexat zur Einnahme.Nach NICO-Sanierung im Oberkiefer links am 08.09.2008 regio 28/29 verschwinden Knieschmerzen sehr schnell. Wieder zeigen sich die typischen histologischen Befunde auch in diesem NICO Areal 28/29: “…Die Markräume zeigen ausschließlich Fettgewebe, hier einerseits ein sehr kleines Areal mit einer frischen Fettgewebsnekrose, diese zeigt fehlende Adipozytenkerne, einzelne eingewanderte neutrophile Granulozyten, Erythrozytenextravasate. ..Andere Areale dann mit Kaliberschwankungen und zum Teil lipoider Degeneration des Zytoplasmas nach Art trophischer Störung.“ Kennzeichnend für die vorliegende fettige Degeneration in regio 28/29 ist der RANTES-Wert dieser NICO-Knochenprobe mit 911.39 pg/ml um das 5 fache gegenüber der Kontrollgruppe und der FGF-2 Wert mit 298,5 pg/ml um das 15 fache erhöht. Wieder ist das in die Grafik eingebettete 2D-OPG nicht geeignet, die im Knochen vorliegenden Entgleisungen der Entzündungsmediatoren adäquat zu repräsentieren, wie in Abbildung 3 gezeigt. Geradezu zwangsläufig muss eine diagnostische Fehlbeurteilung einer möglichen NICO Beteiligung bei den RA Beschwerden folgen.
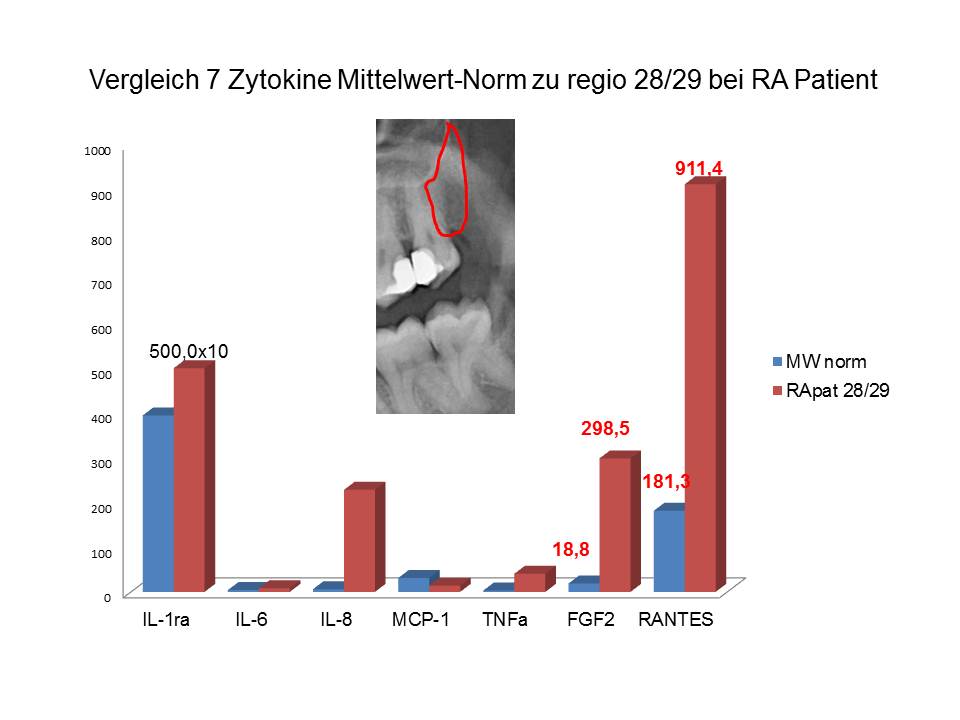
Abb 3: 7 Zytokine aus regio 28/29 bei RA
Relevanz für die Praxis
Ein erweiterter ganzheitlicher ZahnMedizinischer Ansatz lässt folgenden zusammenfassenden Schluss zu: Nicht nur unverträgliche Materialien und Medikamente können über entgleiste Immunmuster zu einem systemischen Stressfaktor im Sinne eines „Störfeldes“ werden, sondern auch die unerkannten blanden Osteopathien des Kieferknochens in Form der fettig-osteolytischen NICO-Osteonekrosen. Deren pathogenetischer, salutogenetischer und diagnostischer Gewichtung sollte in der täglichen Praxis verstärkt werden.
P.S. Daten und wissenschaftliche Literatur dieses Artikels sind entnommen aus: Lechner, J. Kavitätenbildende Osteolysen de Kieferknochens – Systemisch-ganzheitliche Wirkungen der aspetischen Osteonekrosen „Kieferostitis“ und „NICO“ im Kiefer. München 2011 Eigenverlag, 276 Seiten, Farbdruck €34,-
Einen wissenschaftlich erweiterten Artikel „RANTES and fibroblast growth factor 2 in jawbone cavitations: triggers for systemic disease?“ von Dr. Lechner und Dr. Volker v.Baehr im International Journal of General Medicine finden Sie in der medizinischen Datenbank PubMed unter:
https://www.dovepress.com/articles.php?article_id=12842&l=bBexMykzNGYEHIPfWZ1MT6xu198194









 Die Einbindung der Theorie in spannende Fallberichte, erleichtert dem Leser den Zugang zu komplexen gesundheitlichen Fragen. Das Buch klärt leicht verständlich über unbekannte und unerkannte Krankheitsursachen aus dem Zahn- und Kieferbereich auf und hilft chronischem Leiden vorzubeugen. Viele chronisch Kranke leiden an einem Krankheitsbild, das ihnen als solches im Augenblick noch gar nicht bekannt ist: chronische Belastungen aus dem Zahn- und Kieferbereich. Jeder sollte darüber Bescheid wissen, was ihn belastet oder schädigt oder schädigen kann, damit er sich schützt und schützen kann. Die Falldarstellungen dieses Buches zeigen, welch dramatischer Stellenwert einer unter ganzheitlichen Gesichtspunkten betriebenen Zahnheilkunde zukommt. Die Frage verdichtet sich, ob das was der normale Zahnarzt heute praktiziert, nicht möglicherweise chronische Erkrankungen produziert, die einen unbekannt hohen Prozentsatz unserer Bevölkerung betreffen.
Die Einbindung der Theorie in spannende Fallberichte, erleichtert dem Leser den Zugang zu komplexen gesundheitlichen Fragen. Das Buch klärt leicht verständlich über unbekannte und unerkannte Krankheitsursachen aus dem Zahn- und Kieferbereich auf und hilft chronischem Leiden vorzubeugen. Viele chronisch Kranke leiden an einem Krankheitsbild, das ihnen als solches im Augenblick noch gar nicht bekannt ist: chronische Belastungen aus dem Zahn- und Kieferbereich. Jeder sollte darüber Bescheid wissen, was ihn belastet oder schädigt oder schädigen kann, damit er sich schützt und schützen kann. Die Falldarstellungen dieses Buches zeigen, welch dramatischer Stellenwert einer unter ganzheitlichen Gesichtspunkten betriebenen Zahnheilkunde zukommt. Die Frage verdichtet sich, ob das was der normale Zahnarzt heute praktiziert, nicht möglicherweise chronische Erkrankungen produziert, die einen unbekannt hohen Prozentsatz unserer Bevölkerung betreffen.



 Gesunde Zähne – gesunder Mensch (2009) – Die zentrale Frage dieses Buches: Der Zahnarzt – Mechaniker oder Mediziner?
Gesunde Zähne – gesunder Mensch (2009) – Die zentrale Frage dieses Buches: Der Zahnarzt – Mechaniker oder Mediziner? Elemente der Gesundheit (2011 / Beitrag von Dr. Lechner)
Elemente der Gesundheit (2011 / Beitrag von Dr. Lechner)